
题目列表(包括答案和解析)
已知一定温度下,2X(g)+Y(g) ?mZ(g) ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )
A.m=4 B.a=b C.a< D.m≤2
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
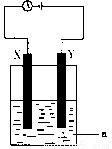
① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
(14分)密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H <0
Z(g);△H <0
下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但各物质的用量都没有改变。
(1)t2 时外界条件的改变可能是 (填序号,下同);t5时外界条件的改变可能是
a.加入催化剂 b.减小压强 c.增大压强 d.升高温度
(2)t3 时,反应物X的转化率 (填“大于”、 “小于”或“等于”)t4时的反应物X的转化率。
(3)在 t 6时,固定容器体积,再向上述容器中充入1 mol氦气,此时,平衡 (填“是”或“否”)会发生移动。
(4)T℃时,若将2 mol X和1 mol Y在1 L的容器中混合,在 t1(t1=2s)时达到平衡,测得Z的浓度为0.5 mol·L-1,则2s 内用物质X表示的平均反应速率为 ;t1时反应物Y的转化率为 ;T℃时,该反应的平衡常数为 。
已知一定温度下,2X(g)+Y(g)  ?mZ(g) ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )
?mZ(g) ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )
A.m=4 B.a=b C.a< D.m≤2
在一定容积的密闭容器中发生反应:X(g)+Y(g)⇌Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图象。下列有关判断正确的是

A.甲图表示温度对X转化率的影响,且Ⅰ温度较低
B.乙图一定表示压强对X体积分数的影响,且Ⅳ压强较高
C.甲图一定表示压强对X体积分数的影响,且Ⅰ压强较高
D.甲、乙图都可以表示温度、压强对平衡的影响,且Ⅰ>Ⅱ,Ⅲ<Ⅳ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com