
题目列表(包括答案和解析)
下列试剂的浓溶液在空气中久置都会变质。在变质过程中既发生了氧化还原反应,又发生了非氧化还原反应的是( )
A.氢氧化钠 B.过氧化氢 C.次氯酸钙 D.硫酸亚铁
A.氢氧化钠 B.过氧化氢 C.次氯酸钙 D.硫酸亚铁
A. 氢氧化钠
B.过氧化氢
C.次氯酸钙
D.硫酸亚铁
下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
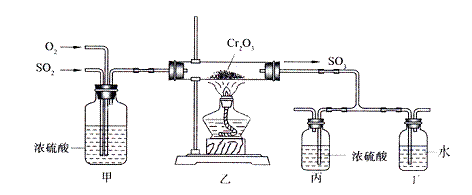
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式 。
(2)写出上图中部分装置的作用:甲:①混合SO2和O2;② ;
丙和丁: 。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;
②
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于 ;丙和丁相当于 。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是 (填下列各项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
 N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com