
题目列表(包括答案和解析)
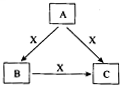 A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
| ||
| ||
 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧杯中不再有气泡产生时,停止反应,此时烧瓶中铜片仍有剩余.再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧杯中不再有气泡产生时,停止反应,此时烧瓶中铜片仍有剩余.再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失.
| ||
| ||
| ||
| ||
| ||
| ||


| ||
| △ |
| ||
| △ |
下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:

(1)将A、C、E相连后,以浓盐酸和 (填写名称)为原料制取Cl2,仪器乙的名称是 。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验 序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
实验Ⅱ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是 。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先 ,再 以使烧杯中的水进入试管丁,观察现象。
(1)SO2是一种________色、有________气味的有毒气体,密度比空气________,容易液化,易溶于水(1∶40).
(2)SO2的化学性质丰富多彩.SO2是一种________氧化物,可以与水、碱、碱性氧化物反应.由于SO2分子中硫元素的化合价为+4,处于S的中间价态,所以SO2既可作还原剂(主要),也可作氧化剂(次要).当SO2遇到强氧化剂时,+4价的S可以被氧化为+6价的S,SO2作为还原剂.例如,SO2能与O2反应生成SO3(写出相应的化学方程式,下同):________;SO2还能使溴水褪色:________.当SO2遇到强还原剂时,+4价的S可以被还原为0价的S,SO2作为氧化剂.例如,SO2可以与H2S反应生成单质硫:________.除此之外,SO2能使________褪色,这是因为SO2具有漂白性,能与有色物质化合生成不稳定的无色化合物.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com