
题目列表(包括答案和解析)
| ||
| ||
| 催化剂 |
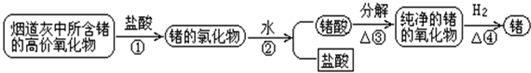
| ||
| ||
| ||
| ||

 如图1所示,其原因是
如图1所示,其原因是
(12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
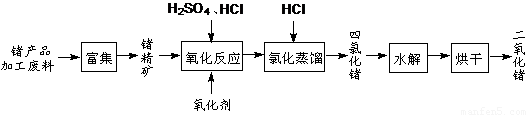
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)
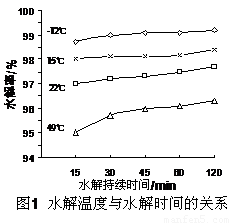
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
|
pH |
4 |
5 |
6 |
7 |
8 |
9 |
|
溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |
(12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com