
题目列表(包括答案和解析)
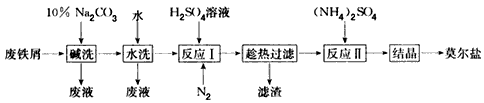
“废铁屑为原料生产莫尔盐的主要流程如下:
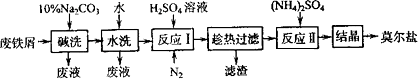
(1)“反应Ⅰ”中通入N2的作用是________________.
(2)称取23.52 g新制莫尔盐,溶于水配制成100 mL溶液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98 g.另一份用0.2000 mol·L-1 K2Cr2O7酸性溶液滴定,当Cr2O![]() 恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25.00 mL.通过计算确定莫尔盐的化学式________.
恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25.00 mL.通过计算确定莫尔盐的化学式________.
(3)若将“水洗”这一步去掉,则所得产品中SO![]() 的质量分数会________(填“偏大”、“偏小”或“不变”).
的质量分数会________(填“偏大”、“偏小”或“不变”).
Ba2+是一种重金属离子,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.
(1)现需配制250 mL 0.100 mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要________.
(2)需准确称取Na2S2O3固体的质量为________g
(3)另取废水50.00 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL.有关的离子方程式为:
①Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O
2Cr3++3I2+7H2O
②I2+2S2O32-![]() 2I-+S4O62-
2I-+S4O62-
试计算该工厂废水中
Ba2+的物质的量浓度.Ba2+是一种重金属离子,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.
(1)现需配制250 mL 0.100 mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要________.
(2)需准确称取Na2S2O3固体的质量为________g
(3)另取废水50.00 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL.有关的离子方程式为:
①Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O
2Cr3++3I2+7H2O
②I2+2S2O32-![]() 2I-+S4O62-
2I-+S4O62-
试计算该工厂废水中Ba2+的物质的量浓度.
Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.
(1)现需配制250 mL 0.100 mol/L标准Na2S2O3溶液,所需的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要________.
(2)需要称取Na2S2O3固体的质量为________g.
(3)另取废水50.00 mL,控制适当的酸度并加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加入过量的KI溶液进行反应,向反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL.已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O;②I2+2S2O32-
2Cr3++3I2+7H2O;②I2+2S2O32-![]() 2I-+S4O62-.计算该工厂废水中Ba2+的物质的量浓度.
2I-+S4O62-.计算该工厂废水中Ba2+的物质的量浓度.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com