
题目列表(包括答案和解析)
 1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C6O分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C6O分子是形如球状的多面体(如图),该结构的建立基于以下考虑: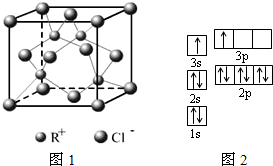 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com