
题目列表(包括答案和解析)
NH3催化氧化法生产硝酸,HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法、是将中间产生的NO2在密闭容器中多次循环用水吸收制备的.
用此方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3.实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物.例如,镁与硝酸反应实验中,测得其气体产物有H2、N2,NO、NO2,液体产物有Mg(NO3)2,NH4NO3和H2O.生成这些产物的HNO3浓度范围为:
H2:c<6.6 mol·L-1;N2和NH4+:c<10 mol·L-1;NO:0.1 mol·L-1<c<10 mol·L-1;NO2:c>0.1 mol·L-1.各气体产物成分及含量随HNO3浓度变化曲线如图所示.

①写出Mg与11mol·L-1的HNO3反应的方程式.
②960 mg Mg与0.1 L 4 mol·L-1的HNO3恰好完全反应,收集到224 mL气体(标准状况),试通过计算写出反应方程式.
(18分)下列八个步骤是用来分析一种含铅锡的合金中铅和锡的个别含量
(1)称量0.4062g的合金,放在烧杯中,用11mol?L-1的HCl和16mol?L-1的HNO3溶液溶解样品。在此过程中铅和锡分别被氧化成Pb(II)、Sn(VI)。
(2)再加热5分钟,以赶走氮和氯的氧化物后,使溶液冷却;此时会有一些锡化合物和一种铅化合物沉淀出。
(3)加入25.00mL 0.2000mol?L-1的Na2H2EDTA(可用H2Y2-表示)溶液后,沉淀会溶解成一透明无色的溶液。
(4)上述溶液全部移入250.0mL的量瓶中,并用蒸馏水稀释到量瓶的刻度上。
(5)拿出25.00mL,加入30%的Hexamine(如下图)溶液15mL、H2O及两滴的类苯酚橙(以XO代表)(如下图)当指示剂,此溶液的pH值为6。
(6)再用标准0.009970mol?L-1的硝酸铅Pb(NO3)2 溶液滴定从第(5)步骤中的黄色透明的溶液,直至颜色刚好由黄色变到红色,此实验值为24.05mL。
(7)取2.0g的固体NaF加入滴定瓶中,此时溶液会变回黄色。
(8)再用0.009970mol?L-1的硝酸铅滴定到颜色变红,此实验值为15.00mL。
Hexamine和类苯酚橙(XO)的结构式如下:
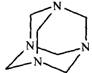
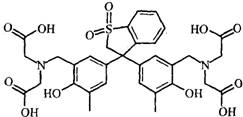
Hexamine 类苯酚橙(XO)
Hexamine的pKb =9.5。类苯酚橙(XO)在pH小于4时是红色,pH大于5时是黄色
回答下列问题
10-1 在步骤(2)中铅的沉淀物是什么?写出其化学式。
10-2 写出步骤(3)中沉淀消失的离子反应方程式(必须平衡)?记得此溶液的pH值为6。
10-3 步骤(5)中为何加入Hexamine?
10-4 加入类苯酚橙(XO)的目的为何?
10-5 写出步骤(6)中,(i)在滴定过程中,以及(ii)滴定终点造成颜色变化时的平衡离子反应方程式。
10-6 步骤(7)中,加入NaF的目的为何?
10-7 写出步骤(7)中的平衡离子方程式。
10-8 用平衡的离子方程式来说明为什么步骤(7)中的颜色会由红变为黄?用XO代表类苯酚橙。
10-9 计算此合金中Pb的重量百分比,再另外计算此合金中Sn的重量百分比。
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
| A.1mol | B.0.05mol | C.1.05mol | D.0.11mol |
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
A.1mol B.0.05mol C.1.05mol D.0.11mol
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
A.1mol B.0.05mol C.1.05mol D.0.11mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com