
题目列表(包括答案和解析)


| 一定条件 |


| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 341 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①浓缩菠萝汁 ②蔗糖 ③柠檬黄 ④山梨酸钾 ⑤水 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装封口处 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
(11分)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是____________。
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是_____________。
(4)元素Cl与S元素相比,非金属性较强的是_____________(用元素符号表示),下列表述中能证明这一事实的是________________
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态
d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是___________________________________________。
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:
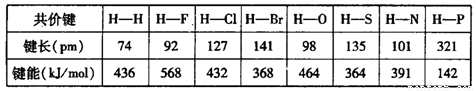
根据表中数据,归纳共价键键能与键长的关系______________________________。
用常见的金属及化合物的知识填空。
(1)过氧化钠可用于宇航员或潜水艇中氧气再生的来源,请分别写出宇航员呼出的水蒸
气和二氧化碳跟过氧化钠反应的化学方程式:
① ;②
(2)铝是一种日常生活中应用很广的重要金属。
①在酒精灯上加热未经打磨的铝箔,出现的现象是 。
②铝制炊具长时间烧煮碱性食物的过程中,铝的保护膜将被破坏。写出铝的保护膜与强碱发生化学反应的离子方程式 。
(3)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列问题:
①自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:
。
②向沸水中逐滴滴加饱和FeC13溶液,至液体呈透明的红褐色,形成该分散系的分散质粒子直径范围是 nm。
③电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeC13溶液与铜反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com