
题目列表(包括答案和解析)
[ ]
| A、碱金属元素原子最外层都只有1个电子 | B、依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 | C、随核电荷数递增,氢氧化物碱性增强 | D、随电子层数增加,原子半径增大,金属还原性增强 |
| A、碱金属元素原子最外层都只有1个电子 | B、随电子层数增加,原子半径增大,金属还原性增强 | C、随核电荷数递增,氢氧化物碱性增强 | D、依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 |
关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子 B.随核电荷数递增,氢氧化物碱性增强
C.随电子层数增加,原子半径增大,金属还原性增强
D.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。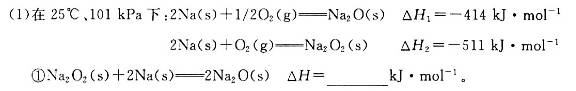
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,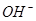 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为: 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 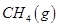 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
①0~10 min内用 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.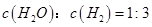
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com