
题目列表(包括答案和解析)

| 实验小组 | 称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 298.7 |
| 二 | 6.4 | 2.56 | 448 |
| ||
| ||
| ||
| ||
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是 NaHCO3 NaHCO3 |
| A+C | 无明显现象 | C是 Na2SO4 Na2SO4 |
| A+D | 产生白色沉淀 | D是 BaCl2 BaCl2 |
| 甲组 | 乙组 | 丙组 | 丁组 | |
| X | BaCl2 | Na2CO3 | KCl | K2CO3 |
| Y | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| Z | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
(17分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验可能用到的仪器如下图所示:
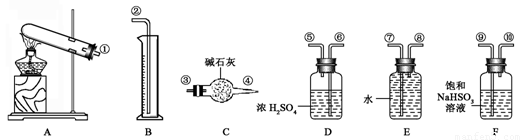
【提出猜想】
Ⅰ.所得气体的成分可能只含 一种;
Ⅱ.所得气体的成分可能含有 二种;
Ⅲ.所得气体的成分可能含有 三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。请回答下列问题:
(1) 请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
__ (填序号)
(2) 若实验结束,B中量筒没有收集到水,则证明猜想 正确。
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由。答:
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
|
一 |
6.4 |
2.56 |
298.7 |
|
二 |
6.4 |
2.56 |
448 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_____________ ;
二组:_ 。
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是________和_______(填代号)。
(14分)化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是 (填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:
试剂X从下列试剂中选择:
a.0.1mol·L-1KMnO4(H2SO4酸化)溶液b.0.5mol·L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为 (填字母序号),生成SO42-主要的离子方程式为 。
②甲组方案中,第iii步的“系列操作”包含的操作名称各为 。
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算。
③乙组设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)

(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 。
(4)用下图装置进行CO2性质的有关实验。

①试剂瓶B中盛有饱和NaHCO3溶液,其目的是 。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com