
题目列表(包括答案和解析)
(6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(8分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(4分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为 (填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
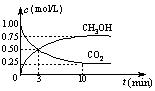
①从3 min到10 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com