
题目列表(包括答案和解析)
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1 418 | 182.7 | 57 | 2 500 |
| A、SiCl4是分子晶体 |
| B、单质B是原子晶体 |
| C、AlCl3加热能升华 |
| D、MgCl2所含离子键的强度比NaCl大 |
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |

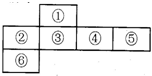 短周期元素中,某些不同族元素的单质及其化合物有相似的化学性质,如铍和铝都能与氢氧化钠溶液反应;如图是元素周期表的一部分,编号为③的元素最外层与最内层电子数相等
短周期元素中,某些不同族元素的单质及其化合物有相似的化学性质,如铍和铝都能与氢氧化钠溶液反应;如图是元素周期表的一部分,编号为③的元素最外层与最内层电子数相等(1)试解释AlF3和 AlCl3的熔沸点存在很大差异的原因。
(2)在500 K和1.01×105 Pa时,测得AlCl3蒸气的密度为
(3)试设计一个实验方案,判断AlCl3是离子化合物还是共价化合物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com