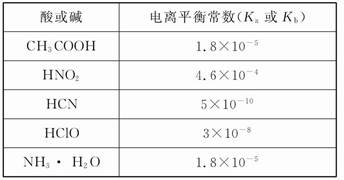
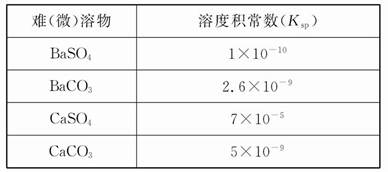
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(K
a)和弱碱的电离平衡常数(K
b),表2是常温下几种难(微)溶物的溶度积常数(K
sp).
表1
| 酸或碱 |
电离平衡常数(Ka或Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×1010 |
| HClO |
3×10-8 |
| NH2?H2O |
1.8×10-5 |
表2
| 难(微)溶物 |
深度积常数(Ksp) |
| BaSO4 |
1×10-10 |
| BaCO3 |
2.6×10-9 |
| CaSO4 |
7×10-5 |
| CaCO3 |
5×10-9 |
请回答下面问题:
(1)CH
3COONH
4的水溶液呈
中性
中性
(选填“酸性”、“中性”或“碱性”),理由是
醋酸铵溶于水后,根据表1中的电离平衡常数,醋酸根结合氢离子和铵根离子结合氢氧根离子生成弱电解质的程度一样,导致溶液中C(OH-)=C(H+)
醋酸铵溶于水后,根据表1中的电离平衡常数,醋酸根结合氢离子和铵根离子结合氢氧根离子生成弱电解质的程度一样,导致溶液中C(OH-)=C(H+)
.溶液中各离子浓度大小关系是
C(CH3COO-)=C(Na+)>C(OH-)=C(H+)
C(CH3COO-)=C(Na+)>C(OH-)=C(H+)
.
(2)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为
C(Na+)>c(CN-)>C(OH-)>C(H+)
C(Na+)>c(CN-)>C(OH-)>C(H+)
.
(3)物质的量浓度和体积均相同的NaNO
2和NaCN两种溶液,已知前者溶液中离子数目为n
1,后者溶液中离子数目为n
2.下列关系正确是:
B
B
.
A. n
1=n
2 B. n
1>n
2 C. n
1<n
2 D.c(NO
2-)<c(CN
-)