
题目列表(包括答案和解析)
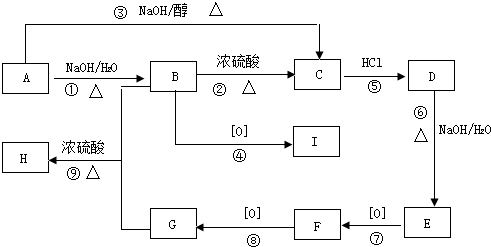
 如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.
如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.
| ||
| ||
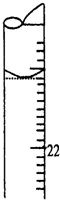 某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com