
题目列表(包括答案和解析)
某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下。
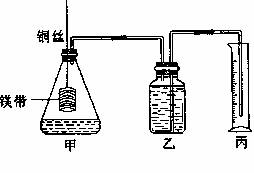
①配制浓度均为1mol/L盐酸和醋酸溶液;
②在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
③用 量取10.00mL 1 mol/L盐酸和醋酸溶液分别加入两个相同的锥形瓶中;
④分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
⑤将铜丝向下移动,使足量的镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读量筒中水的体积前,应
。读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述②检查该装置气密性的操作与观察方法: 。
(2)本实验中应选用 (填序号)的量筒。
A.100mL B.200mL C.500mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算公式为 Vm= 。
(4)① 反应速率不等的原因 ;
② 铜丝不与酸接触的原因 。
某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下。
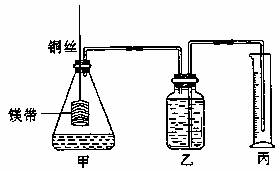
①配制浓度均为1mol/L盐酸和醋酸溶液。
②用 量取10.00mL 1 mol/L盐酸和醋酸溶液分别加入两个相同的锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 。
④将广口瓶中装足量的水,按图连接好装置;检查装置的气密性。
⑤将铜丝向下移动,使足量的镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 。
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读量筒中水的体积前,应
。读出量筒中水的体积为V mL。 请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:
。
(2)本实验中应选用 (填序号)的量筒。
A.100mL B.200mL C.500mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩擦体积的计算公式为:Vm=
。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和3mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
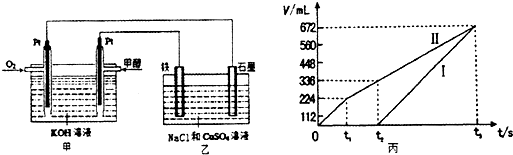
(14分)甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式:
利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为 。
③A中达到平衡时CO2的转化率为 , a= 。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如题1图:
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如题2图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为 。
(14分)甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式:
利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为 。
③A中达到平衡时CO2的转化率为 , a= 。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如题1图: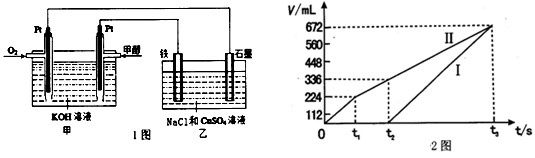
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如题2图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com