
题目列表(包括答案和解析)
| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |

| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | MnSO4 MnSO4 (填写所加甲固体的化学式) |
t |
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4 + 5H2C2O4 + 3H2SO4 ="==" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
[实验内容及记录]
| 实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |

| 实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | | t |
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4 + 5H2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
[实验内容及记录]
|
实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
|
0.6 mol/L H2C2O4溶液 |
H2O |
0.2mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
|
1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
|
2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
|
3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4) = 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
|
实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
|
0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
|
4 |
3.0 |
2.0 |
3.0 |
2.0 |
|
t |
③若该小组同学提出的假设成立,应观察到的现象是 。
(15分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |

| 实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
|
实验编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度 |
||
|
浓度(mol·L-1) |
体积(mL) |
浓度(mol·L-1) |
体积 (mL) |
||
|
① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
|
② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
|
③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
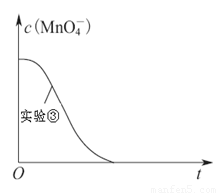
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com