
题目列表(包括答案和解析)
| 1 |
| 3 |








| 键类型 | X-X | X=X | X≡X |
| 键能(kJ/mol) | 159 | 418 | 946 |
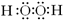
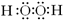
(1)填写元素符号?
A______________________________________;
C______________________________________;?
D______________________________________。?
(2)写出元素E的原子结构示意图__________。?
(3)写出由上述元素组成的具有漂白作用的三种物质的化学式__________________、______________、___________________。?
(4)由A、B、C三种元素形成的化合物的水溶液显碱性,请写出该化合物的电离方程式_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com