
题目列表(包括答案和解析)
在100 mL某一元弱酸(HA)的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )

A.该弱酸在滴定前的浓度是0.15 mol/L
B.该弱酸稀释10倍后pH为4
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定终点时,c(A-)=c(Na+)>c(H+)=c(OH-)
(15分)
实验室通过实验测定NaOH溶液和盐酸反应的中和热.实验需用约450mL 0.50mol/L NaOH溶液.容量瓶(100mL,250mL,500mL各一个)
(1)配制0.50 mol/L NaOH溶液:将NaOH固体放在 (填实验用品或仪器的名称),用托盘天平 g NaOH固体.在使用容量瓶前必须进行的操作是 .
(2)下列操作会使所配溶液的浓度偏高的是(填序号) .
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线.
(3)将50mL 0.50mol/L盐酸与60mL 0.50mol/L NaOH溶液在图所示的装置中进行中和反应.从实验装置上看,图中尚缺少的一种玻璃仪器是 . 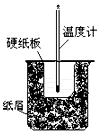
(4)一定量的稀盐酸和过量的NaOH溶液反应,当生成1mol H2O时放出的热量为57.3 kJ,则该反应的热化学方程式为 .
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为 (填字母).
A.a>b>c B.b>c>a C.a="b=c " D.无法比较
某兴趣小组同学取用80.00 g的MgCl2溶液(含镁元素质量分数为15.00%),将其小心蒸干得49.25 g固体(其成分表示为Mgx(OH)yClz•nH2O),为研究其组成进行了如下两实验:
实验一:将所得固体全部溶于100 mL 1.50 mol·L-1的硝酸中,再加水稀释至500 mL,测得溶液的c(H+)=0.1mol·L-1;
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是 ;(填字母序号)
A.均要做,否则无法计算 B.均不要做,数据已经足够 C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
|
名称 |
托盘天平 (带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
|
|
|
|
|
|
|
序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
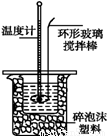
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
|
温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差 平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.6 |
|
|
2 |
27.0 |
27.4 |
27.2 |
31.2 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
试回答下列问题:
(1)a=______________g;
(2)另取a g上述矿石试样溶于400 mL 2.50 mol·L-1 H2SO4溶液,充分反应后,试计算所得溶液中c(H+)(忽略溶液的体积变化)。
(3)将(2)所得溶液以惰性电极电解,当电路中通过0.4 mol电子时,停止电解。试通过计算和推理判断电解过程中阴极上是否一定有金属析出。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com