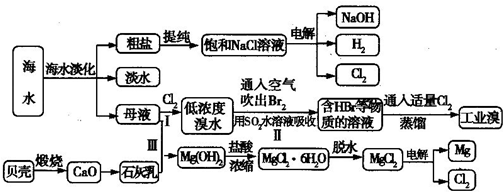
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:

(1)请列举海水淡化的两种方法
蒸馏法
蒸馏法
、
电渗析法
电渗析法
.
(2)步骤Ⅰ中已获得Br
2,步骤Ⅱ中又将Br
2还原为Br
-,其目的是:
富集溴元素
富集溴元素
.步骤Ⅱ用SO
2水溶液吸收Br
2,吸收率可达95%,有关反应的离子方程式
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=4H++SO42-+2Br-
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl
2?6H
2O的原因
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A
A
A.H
2 B.CO
2 C.空气 D.O
2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目的
建一个盐酸厂
建一个盐酸厂
.
(6)上述工艺中可以得到金属Mg,请写出工业上制备金属铝的化学方程式
.