
题目列表(包括答案和解析)
[化学-物质结构与性质]X、Y、Z、W是元素周期表前四周期的4种常见元素,其相关信息如下表:

(1)Y位于元素周期表第________周期________族;Y和Z的最高价氧化物对应的水化物的酸性较强的是________(写化学式).
(2)XY2是一种常见溶剂,XY2的分子中存在________个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是________(用化学式表示),键长较长的是________(用化学式表示).
(3)W的基态原子核外电子排布式是________.
W2Y在空气中煅烧生成W2O的化学方程式是:________.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.已知:
XO(g)+1/2O2(g)=XO2(g);ΔH=-283.0 kJ/mol
Y(s)+O2(g)=YO2(g);ΔH=-296.0 kJ/mol
此反应的热化学方程式是:________.
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A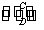 B(在水溶液中进行)
B(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式________;D的电子式________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为____________;由A转化为B的离子方程式为_____________________________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:________________________________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是__________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有_______________________________。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系: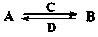 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。常温下,A、B浓度均为0.1mol·L-1的混合溶液中,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
X、Y、Z、U、V是元素周期表前四周期中的五种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
地壳中含量最多的金属,其氧化物可用作耐火材料 |
|
Y |
单质在常温常压下为黄绿色气体 |
|
Z |
常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
|
U |
常温下单质遇浓硫酸钝化,其一种核素的质量数为56,中子数为30 |
|
V |
属短周期元素,原子的最外层电子数是内层电子数的2/5 |
请回答下列问题:
(1)元素X位于周期表中第 周期第 族,其离子结构示意图为 。
(2)上述元素中最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)在碱性条件下,Y的单质可与UO2-反应制备一种可用于净水的盐UO42-,该反应的离子方程式是 。
(4)我国首创的海洋电池被大规模用于海洋灯塔。该电池是以X板为负极,铂网为正极,海水为电解质溶液,电池总反应为:4X+3O2+6H2O=4X(OH)3。该电池正极反应为 。
(5)已知25℃时,Ksp[U(OH)3]=2.63×10-39,则该温度下反应U(OH)3+3H+ U3++3H2O的平衡常数K=
。
U3++3H2O的平衡常数K=
。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)____________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A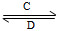 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________;由A转化为B的离子方程式为______________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:______________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com