
题目列表(包括答案和解析)
用相同质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠投入到足量的盐酸中
B.将钠投入到足量的乙醇中
C.将钠用铝箔包好,并刺有小孔,投入足量的水中
D.将钠投入足量硫酸铜溶液中
用相同质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠投入到足量的盐酸中
B.将钠投入到足量的乙醇中
C.将钠用铝箔包好,并刺有小孔,投入足量的水中
D.将钠投入足量硫酸铜溶液中
用相同质量的金属钠进行下列实验,产生氢气的量最多的是:( )
A.将钠放入足量的盐酸溶液中
B.将钠用铝箔包好并刺穿一些小孔,放入足量的乙醇中
C.将钠用铝箔包好并刺穿一些小孔,放入足量的水中
D.将钠放入足量的硫酸铜溶液中
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
 )
)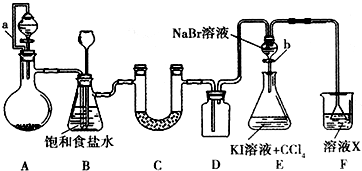 某同学设计如图所示的实验方案,请回答下列问题.
某同学设计如图所示的实验方案,请回答下列问题.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com