
题目列表(包括答案和解析)
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
| ||
| △ |
| ||
| △ |
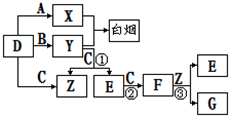 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).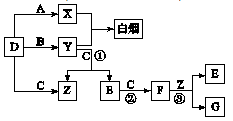
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com