
题目列表(包括答案和解析)
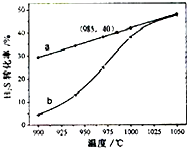 H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )
H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )A、985℃时,H2S按上述反应分解的平衡常数K=
| ||
| B、H2S的分解为吸热反应 | ||
| C、图象能解释,温度升高,反应速率加快 | ||
| D、如果只将上述条件中的温度改为压强,图象的形式基本不变 |

(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3?H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 ,非电解质是 。
(2)H2S溶于水的电离方程式为 。
①向H2S溶液中加入NaOH溶液时,电离平衡向 移动,(填左或右)c(H+) ,c(S2-) 。(填增大或减少或不变)
②向H2S溶液中加入Na2S固体时,电离平衡向 移动, (填左或右)
c(H+) ,c(S2-) 。(填增大或减少或不变)
下列燃烧反应的反应热是燃烧热的是( )
A.H2(g)+1/2O2(g)===H2O(g) ΔH1
B.C(s)+O2(g)===CO(g) ΔH2
C.S(s)+O2(g)===SO2(g) ΔH3
D.H2S(g)+1/2O2(g)===S(s)+H2O(l) ΔH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com