
题目列表(包括答案和解析)
C.1.01×10-4 mol·L-1 D.1.01×10-3 mol·L-1
|
向V mL BaCl2溶液中加入一定体积的0.05 mol L-1H2SO4溶液,两者恰好反应完全,且反应后溶液的pH为3(忽略在混合过程中溶液体积的变化),则原BaCl2溶液的物质的量浓度为 | |
| [ ] | |
A. |
1.01×10-3 mol L-1 |
B. |
5.05×10-3 mol L-1 |
C. |
5.05×10-4 mol L-1 |
D. |
1.01×10-4 mol L-1 |
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学取刚降落在热电厂附近的雨水进行实验.
①测得该雨水样品的pH为4.73;②向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
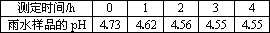
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为________.
(2)分析上述数据变化,你认为形成这一变化的原因是________.
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5 mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液.请计算(列出计算过程):
①该V L雨水中溶解SO2的体积(标准状况)为________mL.
计算过程:
②生成沉淀物的质量范围为________.计算过程:
(7分)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降落在热电厂附近的雨水进行实验。
①测得该雨水样品的pH为4.73;
②向雨水样品中滴加BaCl2溶液,有白色沉淀生成;
③每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为 。
(2)分析上述数据变化,你认为形成这一变化的原因是
。
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。
请计算:①该V L雨水中溶解SO2的体积(标准状况)
②生成沉淀物的质量范围为 (列出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com