
题目列表(包括答案和解析)
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)选择性催化还原法的脱硝原理为:
6NOx+4x NH3 ![]() (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为________L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=__________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
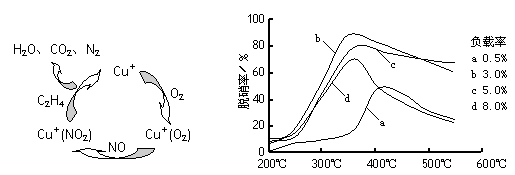
图1 图2
①写出该脱硝原理总反应的化学方程式:____________。
②为达到最佳脱硝效果,应采取的条件是____________。
(1)某次实验所得数据:
加热前质量/g 加热后质量/g
容器 容器+晶体 容器+无水CuSO4
W1 W2 W3
写出所得结晶水含量(x%)的计算公式:____________________________________。
(2)实验时至少要进行几次称量操作?________。为何有时不得不多进行一次称量操作?________________________________________。
(3)若CuSO4×5H2O晶体中含有Na2SO4×10H2O,结果测得结晶水含量为180/411,则混合物中CuSO4×5H2O与Na2SO4×10H2O的物质的量之比为____________。
某学生测定硫酸铜结晶水含量时:
(1)某次实验所得数据:
加热前质量/g 加热后质量/g
容器 容器+晶体 容器+无水CuSO4
W1 W2 W3
写出所得结晶水含量(x%)的计算公式:____________________________________。
(2)实验时至少要进行几次称量操作?________。为何有时不得不多进行一次称量操作?________________________________________。
(3)若CuSO4×5H2O晶体中含有Na2SO4×10H2O,结果测得结晶水含量为180/411,则混合物中CuSO4×5H2O与Na2SO4×10H2O的物质的量之比为____________。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g) ![]() 2NH3(g)的△H= 。
2NH3(g)的△H= 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体积分数为 。

图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮
方法。已知:N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
恒温下,往一个4L的密闭容器中充人2molN2和5.2molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com