
题目列表(包括答案和解析)
(12分)下表是甲城市某日空气质量报告:
|
城市 |
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
|
甲 |
55 |
SO2 |
II |
良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
【探究实验】
实验一:用下图所示装置进行实验。

①A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 。
③D装置的作用是 。若实验中向装置内通入标准状况下2.24L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为 mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的显 性(“酸”“碱”“中”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,
SO3溶于降水生成H2SO4。在此过程中飘尘作 。(填“氧化剂”或“催化剂”)
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】
(1)酸雨造成的危害是: (举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入 (填“水”或“乙醇”)。
【解析】实验一:要检验二氧化硫能否使干燥的试纸变色,就需要事先干燥二氧化硫,即浓硫酸是用来干燥二氧化硫的;二氧化硫是酸性氧化物和水反应生成亚硫酸,亚硫酸是二元弱酸,具有酸的通性;由于二氧化硫属于大气污染物,需要进行尾气处理,氢氧化钠易吸收二氧化硫。2.24L SO2气体是 ,根据硫原子守恒可知Na2SO3的物质的量也是0.1mol。
,根据硫原子守恒可知Na2SO3的物质的量也是0.1mol。
实验二:SO2与空气中的O2在飘尘的作用下反应生成SO3的过程中,飘尘参与反应,但反应前后并没有发生变化,其飘尘的存在,加速了反应的进程,所以是催化剂,氧气才是氧化剂;氮的氧化物一般是NO或NO2,它们在水中最终转化为硝酸;水不能燃烧,不能加水。乙醇是可燃物,且燃烧产物不含造成污染,所以可以加入乙醇。
(12分)下表是甲城市某日空气质量报告:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
【探究实验】
实验一:用下图所示装置进行实验。
①A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 。
③D装置的作用是 。若实验中向装置内通入标准状况下2.24L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为 mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的显 性(“酸”“碱”“中”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,
SO3溶于降水生成H2SO4。在此过程中飘尘作 。(填“氧化剂”或“催化剂”)
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】
(1)酸雨造成的危害是: (举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入 (填“水”或“乙醇”)。
【解析】实验一:要检验二氧化硫能否使干燥的试纸变色,就需要事先干燥二氧化硫,即浓硫酸是用来干燥二氧化硫的;二氧化硫是酸性氧化物和水反应生成亚硫酸,亚硫酸是二元弱酸,具有酸的通性;由于二氧化硫属于大气污染物,需要进行尾气处理,氢氧化钠易吸收二氧化硫。2.24L SO2气体是![]() ,根据硫原子守恒可知Na2SO3的物质的量也是0.1mol。
,根据硫原子守恒可知Na2SO3的物质的量也是0.1mol。
实验二:SO2与空气中的O2在飘尘的作用下反应生成SO3的过程中,飘尘参与反应,但反应前后并没有发生变化,其飘尘的存在,加速了反应的进程,所以是催化剂,氧气才是氧化剂;氮的氧化物一般是NO或NO2,它们在水中最终转化为硝酸;水不能燃烧,不能加水。乙醇是可燃物,且燃烧产物不含造成污染,所以可以加入乙醇。
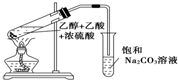
 实验室用如图所示的装置制取乙酸乙酯
实验室用如图所示的装置制取乙酸乙酯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com