
题目列表(包括答案和解析)
| 选项 | 实验操作 | 现象或解释 |
| A | 乙醇与浓硫酸按体积比1:3混合加热,产生的气体通过酸性高锰酸钾溶液 | 高锰酸钾溶液褪色.不能说明一定有乙烯产生,因为乙醇、等也能还原酸性高锰酸钾溶液 |
| B | 一小块金属钠投入无水乙醇中 | 钠块浮在液面上,四处游动.因为钠与乙醇反应产生氢气,推动钠块 |
| C | 二氧化硫通入氯化钡溶液 | 先出现白色沉淀是,最后白色沉淀溶解是生成可溶性的 |
| D | 热的苯酚水溶液自然冷却 | 变浑浊.是因为温度降低析出苯酚晶体 |
| 充电 | 放电 |
(1)下列实验操作或叙述正确的是 (填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴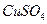 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加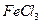 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥定容时,俯视容量瓶刻度,造成所配溶液浓度偏高;
⑦称取5.85g氯化钠固体,用100 mL蒸馏水溶解,得到1.00 mol·L-1氯化钠溶液
(2)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下各步骤的实验:
步骤1测得混合液呈碱性;
步骤2滴加HCl时,溶液中出现气泡。该气体能使饱和石灰水溶液变浑浊; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤4加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
步骤5加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
分析上述5个实验,回答下列问题。
①由实验步骤1判断可能存在的离子有 ;
②由实验步骤2判断可能存在的离子有几种可能性 ;分别是 ;
③由实验步骤3可得出的结论是 ;
④由实验步骤4和实验步骤5可确定肯定存在的离子有 ;
⑤由上述5个实验不能确定是否存在的离子是 。
现有无色透明的晶体A(金属Sn的化合物),某学生做了以下一组实验:
(1)将晶体溶于水,立即生成白色沉淀,若先用盐酸酸化后再稀释,得A的澄清透明溶液。
(2)将A溶液滴入氯化汞溶液,析出白色沉淀B,令A过量时,沉淀由灰色转化为黑色的C。
(3)将氢硫酸滴入A溶液,产生棕黑色沉淀D,D能溶于过硫化铵溶液得E。
(4)取少量晶体A,用硝酸酸化后再稀释,所得之澄清液与硝酸银反应产生白色沉淀F。
(5)F溶于硫代硫酸钠溶液,得无色透明溶液G,稀释G产生白色沉淀H,放置后,沉淀颜色由白变棕,最后变为黑色的I。
请指出A为何物?并写出以上实验各步反应的方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com