
题目列表(包括答案和解析)
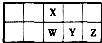 短周期元素W、X、Y、Z在元素周期表中的位置关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z在元素周期表中的位置关系如图所示.下列说法正确的是( )| A.元素Y的最高价氧化物对应水化物的酸性比Z的强 |
| B.元素Z位于元素周期表中的第3周期ⅦA族 |
| C.原子半径的大小顺序:rY>rW>rX |
| D.元素X可能为氮或氧元素 |
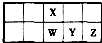
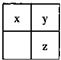 短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( )
短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( )| A、若y和z能形成化合物,则x为氮元素 | B、若x、y、z的单质常温下都是气体,则Y为氧元素 | C、若x、y、z是非金属元素,则它们气态氢化物的水溶液都显酸性 | D、若x、y、z的原子序数之和小于20,则它们都是金属元素 |
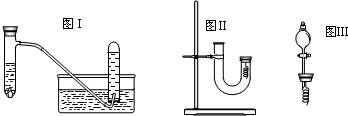
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
(10分).近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-) 
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)
为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+ Sx 、
Sx 、
CO+ Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com