
题目列表(包括答案和解析)
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
| ||
| △ |
| ||
| △ |

| X-Y | X=Y | X≡Y | |
| BD的键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| C2的键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是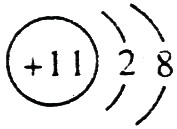 ,C的原子结构示意图是
,C的原子结构示意图是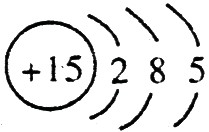 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: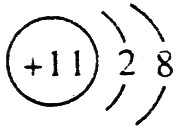 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: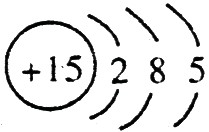 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:_______________________
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=110-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为110-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com