
题目列表(包括答案和解析)


| ||
| ||
| ||
| ||
| ||
| ||
| 元素 | 原子结构或性质 | ||
| A | 原子最外层电子数是内层电子总数的
| ||
| B | 形成化合物种类最多的元素,其单质为固体 | ||
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 | ||
| D | 地壳中含量最多的元素 | ||
| E | 与D同主族 | ||
| F | 与E同周期,且最外层电子数等于电子层数 |
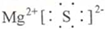
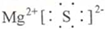
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
A、B、C、X均为中学常见物质,它们有如下转化关系(副产物已略去)。
![]()
试回答:
(1)若A为气态化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色,该转化关系是工业制硝酸的反应原理,则A空间结构是 。
(2)若X是强氧化性单质,则A不可能是_______________;
a.S b.N2 c.Na d.Mg
(3)若X是金属单质,将5~6滴B的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应。C溶液在贮存时应加入少量X,理由是(用离子方程式表示) ;
(4)若A、B、C含同种金属元素,X为强电解质,则A溶液与C溶液反应生成B的离子方程式为_________________________________________________________,
X的化学式可能为________。
(14分).电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置(E中电炉省去)。
(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是__________________(3分)。
(2)C装置中浓H2SO4的作用是__________________。
(3)D装置中MnO2的作用是____________________。
(4)E燃烧管中CuO的作用是______________________。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的最简式为_____________________(3分)。
(6)要确立该有机物的分子式,还要知道________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com