
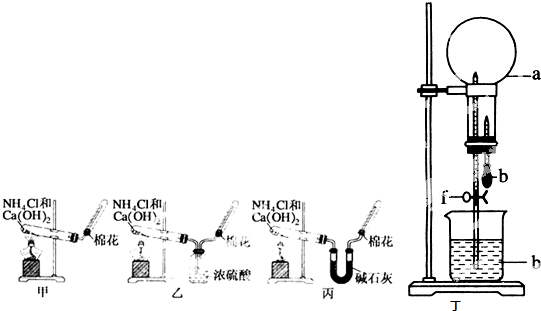
题目列表(包括答案和解析)
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
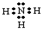
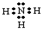
 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-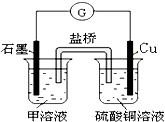
| 第一组 | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | (d) 42.0 | H2Te-1.8 |
| A、abc的化学式分别为Ne2、Br2、HF |
| B、第三组与第四组相比较,化合物的稳定顺序为:HBr>d |
| C、第三组物质溶于水后,溶液的酸性:c>HCl>HBr>HI |
| D、第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com