
题目列表(包括答案和解析)
| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g?l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g?l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g?cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g?cm-3 | 184.4 | 113.5 | 0.029 g |
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |


 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-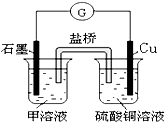

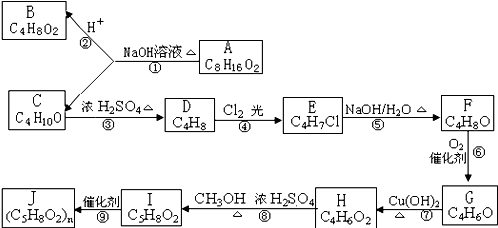
| X-Y | X=Y | X≡Y | |
| BD的键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| C2的键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com