
题目列表(包括答案和解析)
氨气与氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为 ,A的电子式为 。
(2)写出该反应的化学方程式 。
(3)现有1 mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8 g,试计算原混合气中NH3和F2的物质的量可能各是多少?
氨气与氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为 ,A的电子式为 。
(2)写出该反应的化学方程式 。
(3)现有1 mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8 g,试计算原混合气中NH3和F2的物质的量可能各是多少?
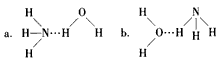
氨气与氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为 ,A的电子式为 。
(2)写出该反应的化学方程式 。
(3)现有1 mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8 g,试计算原混合气中NH3和F2的物质的量可能各是多少?
[化学—物质结构与性质]铜是过渡元素。化合物中,铜常呈现+1价或+2价。
(1)右图为某铜矿晶体结构单元,该铜矿的化学式为________。
(2)已知,铜的第一电离能为746kJ·mol-1,第二电离能为
1958kJ·mol-1。请结合核外电子排布相关知识解释,铜第二电离能远
远大于第一电离能的原因![]()
答:____________________________________。
(3)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大。据此可知,CuCl的溶解度比CuI的溶解度__________(填“更大”或“更小”)。
(4)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为[Cu(NH3) n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
①[Cu(NH3)n]+中n =______________________。
②[Cu(NH3) n]+中Cu+与n个氮原子构成的空间结构呈___________型。
③[Cu(NH3) n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO。加热分解放出CO的过程中,必须克服微粒间的哪类作用力?答:______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com