
题目列表(包括答案和解析)
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→ →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是 。此时锥形瓶内溶液的pH为 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

![]()
![]()
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是 。此时锥形瓶内溶液的pH为 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

![]()
![]()
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
下面是甲、乙、丙3位同学制取己酸乙酯的过程,请你参与并协助他们完成相关的实验任务。
![]() 【实验目的】制取乙酸乙酯
【实验目的】制取乙酸乙酯
![]() 【实验原理】甲、乙、丙3位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸
【实验原理】甲、乙、丙3位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸![]() 乙酯,其反应的化学方程式为 。
乙酯,其反应的化学方程式为 。
![]() 【装置设计】甲、乙、丙3位同学分别设计了下列3套实验装置:
【装置设计】甲、乙、丙3位同学分别设计了下列3套实验装置:
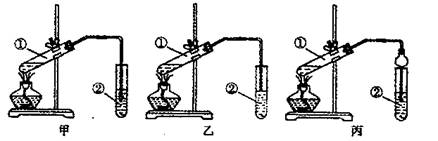
若从甲、乙同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,应选择的装置是 (填“甲”或“乙”)。丙同学将甲装置中的玻璃导管改成了球形干燥管,除起冷凝作用外,另一个重要的作用是 。
![]() 【实验步骤】a. 按所选择的装置组装仪器,在试管①中先加人3 mL 95%的乙醇,并在摇动下加入2 mL浓硫酸,充分摇匀,冷却后再加入2 mL冰醋酸;b. 将试管固定在铁架台上;c. 在试管②中加入5 mL饱和Na2CO3溶液;d.用酒精灯对试管①加热心当观察到试管②中有明显现象时停止实验。
【实验步骤】a. 按所选择的装置组装仪器,在试管①中先加人3 mL 95%的乙醇,并在摇动下加入2 mL浓硫酸,充分摇匀,冷却后再加入2 mL冰醋酸;b. 将试管固定在铁架台上;c. 在试管②中加入5 mL饱和Na2CO3溶液;d.用酒精灯对试管①加热心当观察到试管②中有明显现象时停止实验。
![]() 【问题讨论】
【问题讨论】
![]() (1)步骤a中组装好实验装置后,加入药品前还应检查 。
(1)步骤a中组装好实验装置后,加入药品前还应检查 。
![]() (2)试管②中装有饱和Na2CO3溶液,其作用是 (填序号)
(2)试管②中装有饱和Na2CO3溶液,其作用是 (填序号)
![]() A.吸收乙醇
A.吸收乙醇
![]() B.除去乙酸
B.除去乙酸
![]() C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
![]() D.加速酯的生成,提高其产率
D.加速酯的生成,提高其产率
![]() (3)根据试营②中观察到的现象,可知乙酸乙酯的物理性质有 。
(3)根据试营②中观察到的现象,可知乙酸乙酯的物理性质有 。
下面是甲、乙、丙3位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关的实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙3位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯.
[装置设计]甲、乙、丙3位同学分别设计了下列3套实验装置:

若从甲、乙两位同学设计的装置中选择1套作为实验室制取乙酸乙酯的装置,应该选择的装置是________(填“甲”或“乙”).丙同学将甲装置中的玻璃导管改成了球形干燥管,除起导气和冷凝作用外,另一个重要的作用是________.
[实验步骤]
a.按所选择的装置组装仪器,在试管①中先加入3 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加5 mL饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象停止实验.
[问题讨论]
(1)步骤a中组装好实验装置后,加入样品前还应检查________.
(2)试管②中装有饱和Na2CO3溶液,其作用是________(填字母).
A.吸收乙醇
B.中和乙酸
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)根据试管②中观察到的现象,可知乙酸乙酯的物理性质有________;
(4)写出制乙酸乙酯的化学方程式________;
(5)写出把制得的乙酸乙酯分离出来的方法________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com