(2012?江苏三模)合理地固定和利用CO
2能有效减少空气中的温室气体,产物还能造福人类.
(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H
2S和CO
2合成(C
6H
10O
5)
n和一种淡黄色固体,该反应的化学方程式为
12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O
12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O
.
(2)CO
2可用于合成二甲醚(CH
3OCH
3),有关反应的热化学方程式为:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ?mol
-12CH
3OH(g)?H
3OCH
3(g)+H
2O(g)△H=-23.5kJ?mol
-1①反应2CO
2(g)+6H
2(g)?CH
3OCH
3(g)+3H
2O(g)的△H=
-121.5kJ/mol
-121.5kJ/mol
.
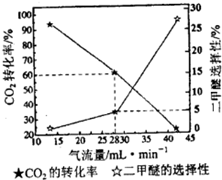
②一定条件下用CO
2和H
2合成二甲醚,反应物气流量对CO
2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min
-1,生产0.3mol二甲醚需通入CO
2的物质的量为
20mol
20mol
.
③反应2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH
3OH,t时刻时,测得c(CH
3OH)=0.03mol?L
-1,c(CH
3OCH
3)=0.6mol?L
-1,此时v
正=
=
v
逆(填“>”、“<”或“等于”)
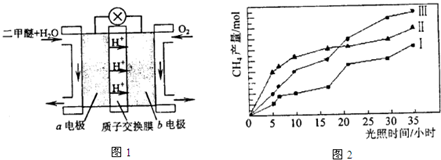
④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.
(3)一种“碳捕捉”技术为:将含CO
2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO
2可用于制备甲醇等.该技术电可以循环使用的物质为
氧化钙和氢氧化钠
氧化钙和氢氧化钠
.
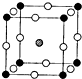
(4)利用光能和光催化剂,可将CO
2和H
2O(g)转化为CH
4和O
2.紫外光照射时,等量的CO
2和H
2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH
4产量随光照时间的变化如图2所示.在0~30小时内,CH
4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
.

 (2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.
(2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.

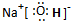
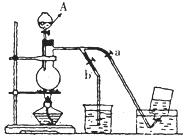 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
