
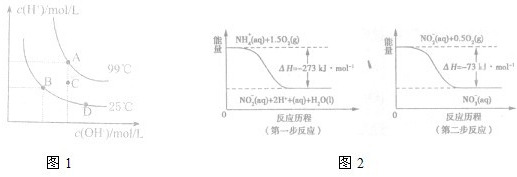
题目列表(包括答案和解析)

用![]() 和硫粉在水溶液中加热反应,可制得
和硫粉在水溶液中加热反应,可制得![]() .10℃和70℃时,
.10℃和70℃时,![]() 在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是
在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是![]() ·5
·5![]() .
.![]() 在酸性溶液中立即完全分解:
在酸性溶液中立即完全分解:
现取15.1g![]() ,溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩,冷却至10℃后析出
,溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩,冷却至10℃后析出![]() ·5
·5![]() 晶体.
晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是________.(填写选项的字母)
[ ]
(2)反应1小时后过滤,其目的是________.
(3)滤液中除![]() 和可能未反应完全的亚硫酸钠外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是:________.
和可能未反应完全的亚硫酸钠外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是:________.
(4)设![]() 跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时,
跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时,![]() 饱和溶液的密度为1.17
饱和溶液的密度为1.17![]() ).
).
(5)若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的![]() ·5
·5![]() 的质量,你认为________.(填写一个选项的字母)
的质量,你认为________.(填写一个选项的字母)
[ ]
A.前面提供的数据已经足够
B.还需要提供100℃时溶液的密度(1.14![]() )
)
C.还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(如选(A)则直接计算,如选(B)或(C)则可选用其数据),计算从10℃,30.0mL溶液中结晶而出的![]() ·5
·5![]() 的质量.
的质量.
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: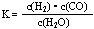 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)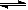 CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g)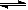 CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g)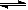 CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g)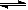 CH3OCH3(g)+CO2(g)的ΔH=__________ ,
CH3OCH3(g)+CO2(g)的ΔH=__________ ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) ? H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
? H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应? N2O4(g)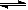 2NO2(g)? △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g)? △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
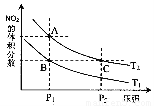
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3 。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
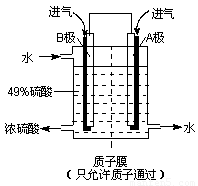
①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
⑴已知某反应的平衡表达式为:
它所对应的化学反应方程式为:
⑵利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8kJ·mol
CH3OH(g);ΔH=-90.8kJ·mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol
③CO(g)+H2O(g) CO2(g)+H2(g);ΔH=-41.3kJ·mol
CO2(g)+H2(g);ΔH=-41.3kJ·mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=__________
CH3OCH3(g)+CO2(g)的ΔH=__________
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。
对反应:N2O4(g) 2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是。
2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是。

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)CO2(g)+3H2(g)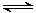 CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
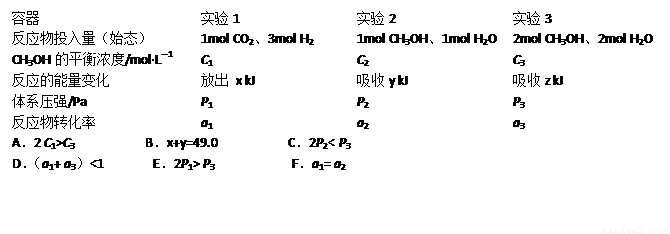
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com