
题目列表(包括答案和解析)
| 1 |
| 2 |
| 1 |
| 2 |

| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




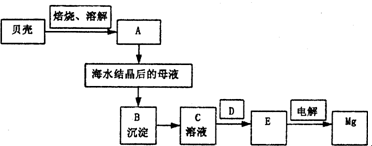
由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:

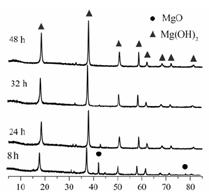



(1)从图可以得出的结论为 、 。
(2)水化反应MgO+H2O = Mg(OH)2能自发进行的原因是 。
(3)结合元素周期律和表1可知,金属氢氧化物受热分解的规律有 。(写一条即可)
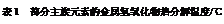
|
LiOH |
NaOH |
KOH |
Al(OH)3 |
Mg(OH)2 |
Ca(OH)2 |
Ba(OH)2 |
|
924 |
不分解 |
不分解 |
140 |
258 |
390 |
700 |
(4)已知热化学方程式:Mg(OH)2 (s) =" MgO" (s)+H2O (g) ΔH =" 81.5" kJ·mol-1
①Mg(OH)2起阻燃作用的主要原因是 。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com