
题目列表(包括答案和解析)
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuS | PbS | MnS |
| Ksp | 2.2×10-20 | 2.6×10-39 | 6.3×10-36 | 8×10-28 | 2×10-10 |
| ||
| ||
I.下图表示从固体混合物中分离Q的2种方案,请回答有关问题。

(1)选用方案(i)时,Q应该具有的性质是_____________,残留物应该具
有的性质是__________________________________。
(2)选用方案(ii)从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂为____________。
(3)为提纯某Fe2O3样品(主要杂质有SiO2.Al2O3),参照方案(i)和(ii),请设计一种以框图形式表示的实验方案(注明物质和操作):
______________________________________________________________________________。
Ⅱ.某种含有少量氧化钠的过氧化钠样品(己知样品质量为1.560g、锥形瓶和水的质量为
190.720g),利用右下图所示装置测定混合物中Na2O2的质量分数,每隔相同时间读得电
子天平的数据如下表:
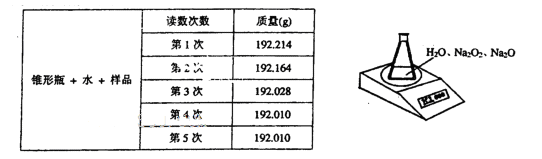
(4)写出Na2O2与H2O反应的化学方程式:________________________________________.
(5)计算Na2O2质量分数时,必需的数据是_________________________________________.
不必作第6次读数的原因是_____________________________________________________.
(6)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:

操作②的名称是____________,该方案需直接测定的物理量是_____________ ,测定过程中
需要的仪器有电子天平、蒸发皿、酒精灯,还需要___________、__________(固定、夹
持仪器除外),在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_______(填
“偏大”、“偏小”或“不变”)。
I.下图表示从固体混合物中分离Q的2种方案,请回答有关问题。
(1)选用方案(i)时,Q应该具有的性质是_____________,残留物应该具
有的性质是__________________________________。
(2)选用方案(ii)从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂为____________。
(3)为提纯某Fe2O3样品(主要杂质有SiO2.Al2O3),参照方案(i)和(ii),请设计一种以框图形式表示的实验方案(注明物质和操作):
______________________________________________________________________________。
Ⅱ.某种含有少量氧化钠的过氧化钠样品(己知样品质量为1.560g、锥形瓶和水的质量为
190.720g),利用右下图所示装置测定混合物中Na2O2的质量分数,每隔相同时间读得电
子天平的数据如下表:
(4)写出Na2O2与H2O反应的化学方程式:________________________________________.
(5)计算Na2O2质量分数时,必需的数据是_________________________________________.
不必作第6次读数的原因是_____________________________________________________.
(6)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
操作②的名称是____________,该方案需直接测定的物理量是_____________ ,测定过程中
需要的仪器有电子天平、蒸发皿、酒精灯,还需要___________、__________(固定、夹
持仪器除外),在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_______(填
“偏大”、“偏小”或“不变”)。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuS | PbS | MnS |
| Ksp | 2.2×10-20 | 2.6×10-39 | 6.3×10-36 | 8×10-28 | 2×10-10 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com