
常温下钛的化学活性很小,在较高温度下可与多种物质反应.
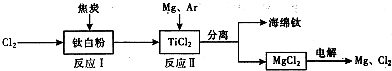
(1)工业上由金红石(含TiO
2大于96%)为原料生产钛的流程如下:

①沸腾氯化炉中发生的主要反应为
TiO2+2C+2Cl2=TiCl4+2CO
TiO2+2C+2Cl2=TiCl4+2CO
.
②已知:Ti(s)+2Cl
2 (g)═TiCl
4(l);△H=a kJ?mol
-12Na(s)+Cl
2(g)═2NaCl(s);△H=b kJ?mol
-1Na(s)═Na(l);△H=c kJ?mol
-1则TiCl
4(l)+4Na(l)═Ti(s)+4NaCl(s);△H=
2b-4c-a
2b-4c-a
kJ?mol
-1.
③TiCl
4遇水强烈水解,写出其水解的化学方程式:
TiCl4+4H2O?Ti(OH)4↓+4HCl↑
TiCl4+4H2O?Ti(OH)4↓+4HCl↑
.
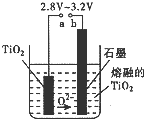
(2)TiO
2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电源
负
负
极,该极电极反应为
TiO2+4e-=Ti+2O2-
TiO2+4e-=Ti+2O2-
.但此法会产生有毒气体,为减少对环境的污染,在电池中用固体氧离子隔膜(氧离子能顺利通过)将两极产物隔开,再将石墨改为某金属陶瓷电极并通入一种还原性气体,该气体是
氢气
氢气
.
(3)海绵钛可用碘提纯,原理为Ti(s)+2I
2(g)
TiI
4(g),下列说法正确的是
CD
CD
(填字母).
A.该反应正反应的△H>0
B.在不同温度区域,TiI
4的量保持不变
C.在提纯过程中,I
2的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I
2可循环利用.


 常温下钛的化学活性很小,在较高温度下可与多种物质反应.
常温下钛的化学活性很小,在较高温度下可与多种物质反应.