
题目列表(包括答案和解析)
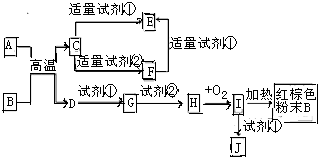 如图为中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题:
如图为中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题: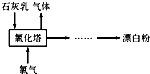 氯气是重要的化工原料.
氯气是重要的化工原料.| C(H+)C(Cl-)C(HClO) |
| C(Cl2) |
| C(H+)C(Cl-)C(HClO) |
| C(Cl2) |
| ||
| ||

| c(N2O3) |
| c(NO)?c(NO2) |
| c(N2O3) |
| c(NO)?c(NO2) |
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。

③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。

(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
硫、氮、稀土元素的单质和化合物应用广泛。
Ⅰ.(1)将硫铁矿和焦炭放在炼硫炉中,在有限空气中燃烧,发生下列反应:
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
生成3mol硫时,被氧化的物质物质的量为__ _________。
(2)过硫酸钾化学式为:K2S2O8,过硫酸结构式为
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是 。
A.CuO B.MnO2 C.Fe2O3 D.NaNO3
②已知硫酸锰(MnSO4)和过硫酸钾两种盐溶液在催化剂存在下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。请写出上述反应的化学方程式:____________ __________。
③若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,由CeCl3·6H2O制备无水CeCl3应采取的措施是 _ _。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com