
题目列表(包括答案和解析)
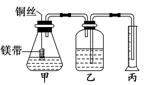
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。

![]()
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
某研究性学习小组为证明在同温同压下,相同浓度、
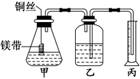 相同体积酸性不同的两种二元酸与足量镁带反应时,生成
相同体积酸性不同的两种二元酸与足量镁带反应时,生成
氢气的体积相同而反应速率不同,同时测定实验室条件下
的气体摩尔体积.设计的简易实验装置如图所示.该实验的
主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记
录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:

Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com