
题目列表(包括答案和解析)
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu 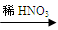 Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu 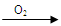 CuO
CuO 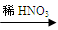 Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。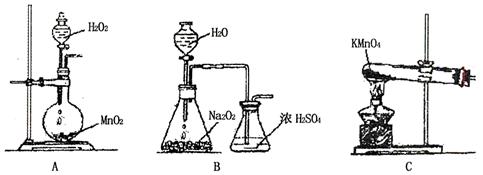
③有下述装置(如下图),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g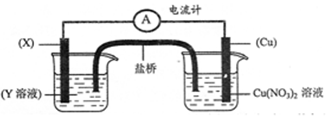
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;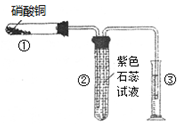
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。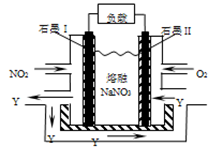
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是 。
(2)为了充分利用反应放出的热量,接触室中应安装 (填设备名称);吸引塔中填充许多瓷管,其作用是 。
(3)吸收塔排放的尾气中含有少量的SO ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
传统的方法是:尾气中的SO 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
,其优点是
。
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
,其优点是
。
创新方法是:将尾气中的SO 用Na
用Na SO
SO 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
,创新方法与传统方法相比,其优点是 。
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
,创新方法与传统方法相比,其优点是 。
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是 (填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO 与杂质反应
与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO 的转化率
的转化率
C.SO 被氧化为SO
被氧化为SO 时需要使用催化剂,这样可以提高SO
时需要使用催化剂,这样可以提高SO 的转化率
的转化率
D.SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO
用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 吸收完全
吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气
m ( O
( O 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是 。
(2)为了充分利用反应放出的热量,接触室中应安装 (填设备名称);吸引塔中填充许多瓷管,其作用是 。
(3)吸收塔排放的尾气中含有少量的SO![]() ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
传统的方法是:尾气中的SO![]() 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式: ,其优点是 。
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式: ,其优点是 。
创新方法是:将尾气中的SO![]() 用Na
用Na![]() SO
SO![]() 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式: ,创新方法与传统方法相比,其优点是 。
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式: ,创新方法与传统方法相比,其优点是 。
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是 (填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO![]() 与杂质反应
与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO![]() 的转化率
的转化率
C.SO![]() 被氧化为SO
被氧化为SO![]() 时需要使用催化剂,这样可以提高SO
时需要使用催化剂,这样可以提高SO![]() 的转化率
的转化率
D.SO![]() 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO
用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO![]() 吸收完全
吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气 m![]() ( O
( O![]() 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是 。
(2)为了充分利用反应放出的热量,接触室中应安装 (填设备名称);吸引塔中填充许多瓷管,其作用是 。
(3)吸收塔排放的尾气中含有少量的SO ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
传统的方法是:尾气中的SO 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式: ,其优点是 。
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式: ,其优点是 。
创新方法是:将尾气中的SO 用Na
用Na SO
SO 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:  ,创新方法与传统方法相比,其优点是 。
,创新方法与传统方法相比,其优点是 。
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是 (填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO 与杂质反应 与杂质反应 |
B.硫酸生产中常采用高压条件,目的是提高SO 的转化率 的转化率 |
C.SO 被氧化为SO 被氧化为SO 时需要使用催化剂,这样可以提高SO 时需要使用催化剂,这样可以提高SO 的转化率 的转化率 |
D.SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 吸收完全 吸收完全 |
 ( O
( O 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。(20分)
(I)多项选择题(6分)
关于化工生产的下列叙述中,正确的是 。
A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.加热法只适用于软化暂时硬度的硬水
D.工业上采用电解熔融氯化铝生产金属铝
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)(14分)
工业上制取硝酸铵的流程图如下,请回答下列问题:?
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;
在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
|
| 注意事项 | 理由 |
| ① |
|
|
| ② |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com