
题目列表(包括答案和解析)
一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g)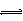 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K=????????????????? ;根据下图,升高温度,K值将??????? (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是?? (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是?????? (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是??????? (填字母)。
a、c(H2)减少
b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加
d、重新平衡时c(H2)/ c(CH3OH)减小
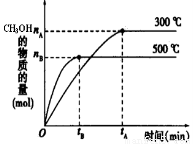
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为:?????????????????????????????????????????????? 。
一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
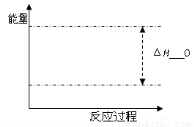
(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少
b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加
d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | | | | |
| ③ | | 粗颗粒 | | |
| ④ | | | |
 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
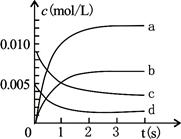
(3)右图中表示NO2变化的曲线是 ;

(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
甲醇合成反应为:CO(g)+2H2(g) ![]() CH3OH(g) 工业上用天然气为原料,分为两阶段制备甲醇:
CH3OH(g) 工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g)![]() CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧 化碳体积比为__________。
化碳体积比为__________。
(2)合成甲醇:①反应过程中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________ 。
实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
 (表中数据单位:mol·L—1)
(表中数据单位:mol·L—1)
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系 产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
 (3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示甲醇燃料电池, 该电池负极的电极反应式为 ;工作一段时间后,当9.6g甲醇完全反应时,有 NA个电子转移。
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示甲醇燃料电池, 该电池负极的电极反应式为 ;工作一段时间后,当9.6g甲醇完全反应时,有 NA个电子转移。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com