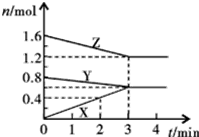
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化
的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式:
;
(2)0-2min末,X的平均反应速率为:
mol?L
-1?min
-1;
(3)3min后图中曲线所表示的含义是:
;
(4)平衡时容器内压强与起始时容器内压强的比值为:
;
(5)其他条件不变,增大容器容积,平衡
(填“向正反应方向”或“向逆反应方向”或“不”)移动;达平衡后若升高温度,Y的百分含量增大,则正反应为
(填“放热”或“吸热”)反应;
(6)上述反应达平衡后若再投入0.2molY和0.4molZ,则再次达到平衡后Y的百分含量为
(填数值),与原平衡相比 Y的百分含量
(填“增大”或“减小”或“不变”);
(7)上述反应达平衡后若再投入0.2molY和0.5molZ,则再次达到平衡后Y的平衡转化率
(填“增大”或“减小”或“不变”),Z的平衡转化率
(填“增大”或“减小”或“不变”).

 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化