
题目列表(包括答案和解析)
| ||
| ||

| ||
| ||
 (2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:(10分)下列转化关系中,X、Y是生活中用处广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题
(1) 请写出反应①的化学方程式:______________
(2) 检验D溶液中问离子的方法是______________;
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式_______;
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制备一种髙效净水剂Y(OH)SO4,已知还原产物为N0,则该反应的化学方程式是_______;
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为_______kg。
(10分)下列转化关系中,X、Y是生活中用处广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题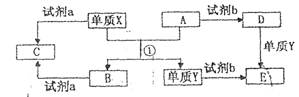
(1) 请写出反应①的化学方程式:______________
(2) 检验D溶液中问离子的方法是______________;
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式_______;
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制备一种髙效净水剂Y(OH)SO4,已知还原产物为N0,则该反应的化学方程式是_______;
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为_______kg。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com