
题目列表(包括答案和解析)
| 高温 |
| 高温 |
| 高温 |
| 实验 组别 |
温度℃ | 起始量/mol | 平衡/mol | 达平衡所 需时间/min | ||||
| H2O | CO | H2 | CO2 | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 0 | a | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0 | b | 0.4 | 1.6 | 3 |
| 高温 |
| 组别 | 温度 | 催化剂 | … |
| 1 | |||
| 2 | |||
 CO(g)+H2(g);△H=+131.3kJ/mol
CO(g)+H2(g);△H=+131.3kJ/mol CO(g)+H2(g)正反应速率增大的是_______;
CO(g)+H2(g)正反应速率增大的是_______; CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验 组别 | 温度℃ | 起始量/mol | 平衡/mol | 达平衡所 需时间/min | ||||
| H2O | CO | H2 | CO2 | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | a | 1.6 | 2.4 | 5 | |
| 2 | 900 | 1 | 2 | b | 0.4 | 1.6 | 3 | |
 CO(g)+H2O(g)化学平衡常数为______;
CO(g)+H2O(g)化学平衡常数为______;| 组别 | 温度 | 催化剂 | … |
| 1 | |||
| 2 | |||
 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
 CO(g) + H2O(g),在该容器内各物质的浓度变化如下
CO(g) + H2O(g),在该容器内各物质的浓度变化如下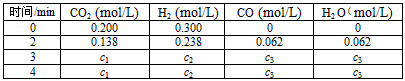

 CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。
CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。 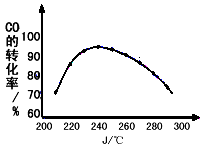
(I某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:
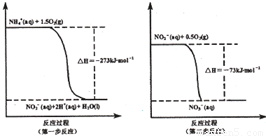
(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 _ 。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成 N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_ 。
(B)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术
将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2 △H
2CO2+ N2 △H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
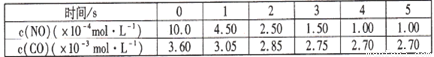
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)
(2)在该温度下,反应的平衡常数K= (只写出计算结果);
(3)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,
部分实验条件如下表:

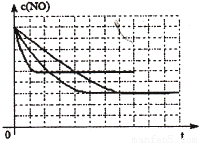
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号;
(I某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下: 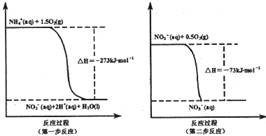
(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 _ 。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成 N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_ 。
(B)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术
将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2 △H
2CO2+ N2 △H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表: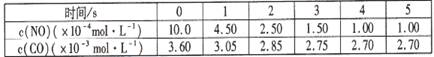
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)
(2)在该温度下,反应的平衡常数K= (只写出计算结果);
(3)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,
部分实验条件如下表:
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号; 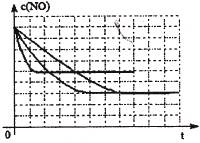
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com