
题目列表(包括答案和解析)
A、B、C、D为中学化学中常见的四种气体单质.
(1)已知在空气中A约占21%、C约占78%(均为体积分数);D在标准状况下的密度为3.170 g·L-1.分别写出A、C、D的化学式:A________、C________、D________.SO2通入D的水溶液中,可以发生氧化还原反应,其化学方程式为:________.
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙.已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物.
甲、乙的化学式是:甲________、乙________;丙的电子式是:________.
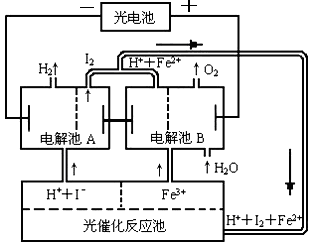
(3)乙可以发生如下图所示一系列转化(无关物质及反应条件已略去):
单质A与化合物乙反应的化学方程式为________.
Z的稀溶液与过量铁粉反应,当反应中有1.806×1023个电子转移时,被还原的Z物质的量是________mol.
(4)将B、C按体积比为3∶1混合分别装入盛有催化剂的密闭容器Ⅰ和Ⅱ中(容积相同),若反应过程中容器Ⅰ保持温度和压强不变,容器Ⅱ保持温度和容积不变,当反应达平衡时,容器Ⅰ内气体的密度________容器Ⅱ内气体的密度(填“大小”“小于”或“等于”),理由是________.在容器Ⅰ中,当反应达平衡时容积变为起始时的![]() ,则C的转化率为________.
,则C的转化率为________.
| |||||||||||||||||||
A、B、C、D为中学化学中常见的四种气体单质.
(1)已知在空气中A约占21%、C约占78%(均为体积分数);D在标准状况下的密度为3.170 g/L.
分别写出A、C、D的化学式:A________、C________、D________.
SO2通入D的水溶液中,可以发生氧化还原反应,其化学方程式为:
___________________________________
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙.已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物.
甲、乙的化学式是:甲________、乙________;丙的电子式是:________.
(3)乙可以发生如图所示一系列转化(无关物质及反应条件已略)
单质A与化合物乙反应的化学方程式________.
Z的稀溶液与过量铁粉反应,当反应中有1.806×1024个电子转移时,被还原的Z物质的量是________mol.
(4)将B、C按体积比为3∶1混合分别装入盛有催化剂的密闭容器Ⅰ和Ⅱ中(容积相同),若反应过程中容器Ⅰ保持温度和压强不变,容器Ⅱ保持温度和容积不变,当反应达平衡时,容器Ⅰ内气体的密度________容器Ⅱ内气体的密度(填“大于”“小于”或“等于”),理由是________.
在容器Ⅰ中,当反应达平衡时容积变为起始时的![]() ,则C的转化率为________.
,则C的转化率为________.
Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。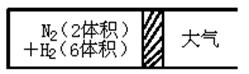
 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com