
题目列表(包括答案和解析)
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/ | 参考价格/ |
| ① | CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4·12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3·5H2O | 52.5 | 49.7 | 1400~1800 |

空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。请回答下列问题:
(1)S、N、O的第一电离能由大到小的顺序为 。
(2)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
①写出亚铁离子的基态电子排布式 。
②CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,CO有多种等电子体,其中常见的两种为 。
(3)SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中 常在燃煤中加入CaO以“固硫”。CaO晶胞如图所示,其中Ca2+的配位数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO—3 401kJ/mol、NaCl—786kJ/mol。CaO晶体的熔点 NaCl晶体的熔点(填“高于”、“等于”或“低于”)。

(4)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5℃),甲醛是“假酒”中的主要有害物质(其沸点是64.65℃),1mol甲醛分子中![]() 键的数目为 ,甲醇的沸点明显高于甲醛的主要原因是 。
键的数目为 ,甲醇的沸点明显高于甲醛的主要原因是 。
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/ | 参考价格/ |
| ① | CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4·12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3·5H2O | 52.5 | 49.7 | 1400~1800 |
其中最适宜作为储能介质的是 。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:
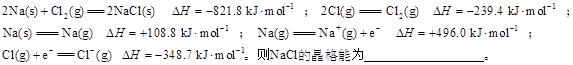
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
|
序号 |
盐 |
熔点/℃ |
熔化热/ |
参考价格/ |
|
① |
CaCl2·6H2O |
29.0 |
37.3 |
780~850 |
|
② |
Na2SO4·10H2O |
32.4 |
77.0 |
800~900 |
|
③ |
Na2HPO4·12H2O |
36.1 |
100.1 |
1800~2400 |
|
④ |
Na2SiO3·5H2O |
52.5 |
49.7 |
1400~1800 |
其中最适宜作为储能介质的是 。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:

(15分)(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是 (填“极性”、“非极性”)分子。
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是__________。(填名称)
②A单质和B单质充分反应生成的化合物的电子式是____________。
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子的符号为________。
(3)NH3·H2O的电离方程式为NH3·H2ONH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。CoCl3·5NH3中Co化合价为 ,请写出表示此配合物结构的化学式: ,
(5)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是
(6)Mg晶体的熔点比Na晶体 (填“高”或“低”),原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com