
题目列表(包括答案和解析)
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂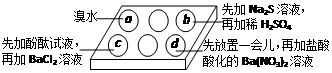
对实验现象的“解释或结论”错误的是
| 选项 | 实验现象 | 解释或结论 |
| A | a中溴水褪色 | 还原性:SO32—> Br— |
| B | b中加硫酸后产生淡黄色沉淀 | SO32—和S2—在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32—+H2O HSO3—+OH—,所以滴入酚酞变红; HSO3—+OH—,所以滴入酚酞变红;Ba2++SO32—→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
|
实验操作 |
实验现象 |
结论 |
|
①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 |
溶液不变红 |
Fe2+遇SCN-不变红 |
|
②向①的溶液中加3%的H2O21滴并振荡 |
立即出现血红色 振荡后不褪色 |
加入H2O2后溶液中 出现了 (离子符号) |
|
③向②的溶液中继续加H2O2溶液 |
溶液中出现大量气泡 血红色褪去 |
|
|
④用带火星的木条检验③中的气体 |
木条复燃 |
则假设 成立 |
探究2
|
实验操作 |
实验现象 |
结论 |
|
①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 |
无明显现象 |
|
|
②向①所得的溶液中滴加3%的H2O2 |
溶液中出现白色沉淀并有少量气泡
|
白色沉淀为BaSO4
|
|
③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 |
|
KSCN被H2O2氧化生成了SO2和CO2气体 |
三、问题与讨论
(1)探究1中,H2O2分解速度很快的原因
(2)探究1中,说明还原性Fe2+ SCN-
(3)探究2中,酸性KMnO4溶液的作用是
能证明生成了CO2的现象是
(4)若SCN -被H2O2氧化得到N2、SO2、CO2和SO42-,且SO2与SO42-的物质的量比为1:1,试写出该反应的离子方程式
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
| 实验操作 | 实验现象 | 结论 |
| ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 | 溶液不变红 | Fe2+遇SCN-不变红 |
| ②向①的溶液中加3%的H2O21滴并振荡 | 立即出现血红色 振荡后不褪色 | 加入H2O2后溶液中 出现了 (离子符号) |
| ③向②的溶液中继续加H2O2溶液 | 溶液中出现大量气泡 血红色褪去 | |
| ④用带火星的木条检验③中的气体 | 木条复燃 | 则假设 成立 |
| 实验操作 | 实验现象 | 结论 |
| ①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 | 无明显现象 | |
| ②向①所得的溶液中滴加3%的H2O2 | 溶液中出现白色沉淀并有少量气泡 | 白色沉淀为BaSO4 |
| ③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 | | KSCN被H2O2氧化生成了SO2和CO2气体 |
 Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀
Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀 Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀
Fe(OH)3+3H+,CaCO3+2H+=Ca2++H2O+CO2↑,促进Fe3+水解生成Fe(OH)3沉淀 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-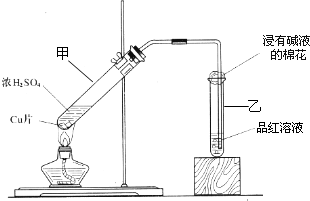 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题: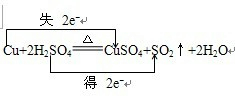

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com