为了测定某烷烃样品(丁烷,并含少量丙烷等气态烃)的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量为m
1.
②往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到质量m
2.
③往锥形瓶内加满水,塞好胶塞,称量得到质量m
3.
已知实验时的温度T(K),压强p(kPa),水的密度ρ
水(g?mL
-1),空气的平均相对分子质量为29.0,密度ρ
空气(g?L
-1).回答下列问题:
(1)本实验的原理是(具体说明)
根据阿伏加德罗定律,同温同压下,两种同体积的不同气体的质量之比等于它们的相对分子质量之比.
根据阿伏加德罗定律,同温同压下,两种同体积的不同气体的质量之比等于它们的相对分子质量之比.
.
(2)步骤②中为什么要重复操作,直到前后两次称量结果基本相同?答
为了保证瓶内的空气已完全被排出,并充满了样品气体.
为了保证瓶内的空气已完全被排出,并充满了样品气体.
.
(3)具体说明本实验中怎样做到每次测量都是在相同体积下进行的.
(4)由实验测得该烷烃的平均相对分子质量是
(列算式).

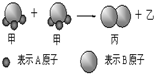 如图所示,2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )
如图所示,2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )